Firmy farmaceutyczne coraz częściej korzystają z przyspieszonych procesów zatwierdzania lekarstw, aby dostarczyć pacjentom często niesprawdzone metody leczenia.
„Leki zdobywamy coraz szybciej, wiemy o nich coraz mniej i płacimy za nie coraz więcej”
– prof. Gregg Gonsalves
Jeden z leków na ALS (stwardnienie zanikowe boczne), który przyniósł producentowi dochód w wysokości 400 milionów dolarów, okazał się być nieskuteczny. Podobnie z lekarstwem na raka, które przyniosło 500 milionów dolarów, ale nie miało żadnego wpływu na przeżywalność pacjentów. Nawet lek na białaczkę, który zarobił prawie 850 milionów dolarów dla swojego producenta, został wycofany z użycia po tym, jak okazało się, że był związany z przypadkami śmierci pacjentów w poprzednich latach.
Wszystkie z nich dopuszczono do sprzedaży w wyniku dążenia Agencji ds. Żywności i Leków do szybszego dostarczania pacjentom nowych leków - czasami nawet przed zakończeniem testów.
Rozterki FDA
FDA znajduje się pod nieustanną presją pacjentów i producentów. Ci pierwsi nie chcą latami czekać na ratujące życie lekarstwa, ci drudzy chcą jak najszybciej wprowadzić swoje produkty na rynek tłumacząc to potrzebami pacjentów. Jednak przyspieszanie tego procesu czasami nie jest korzystne dla chorych, choć zwykle okazuje się takie dla producentów.
Agencja znajduje się więc pod dużą presją, aby działać szybciej, a dynamika ta ma swoje korzenie w kryzysie związanym z AIDS, kiedy pacjenci umierali w oczekiwaniu na nowe, ratujące życie leki, które utknęły w długim procesie ich zatwierdzania. Jednak z biegiem lat stosowane kiedyś sporadycznie szybsze zatwierdzenie zmieniło się na tyle, że zdaniem krytyków powoduje zamieszanie i może narażać ludzi na ryzyko.
Firmy farmaceutyczne jednak na tym zarabiają. Od 2014 r. zarobiły co najmniej 3,6 miliarda dolarów na globalnej sprzedaży leków, które później okazały się nieskuteczne, a ich zastosowanie w USA w większość lub w całości zostało wstrzymane – informuje Bloomberg, który przeprowadził analizę.
„Leki zdobywamy coraz szybciej, wiemy o nich coraz mniej i płacimy za nie coraz więcej” – mówi profesor zdrowia publicznego Uniwersytetu Yale Gregg Gonsalves, były działacz na rzecz AIDS, który należał do grupy domagającej się od FDA szybszych działań – ale także bardziej rygorystycznych – w latach 90.
Według Gonsalvesa grupy pacjentów, które obecnie nalegają na szybkie zatwierdzanie leków, wyciągnęły błędne wnioski z kryzysu związanego z HIV.
„Nie chodzi o to, by mieć więcej lekarstw. Chodzi o to, by mieć takie, które działają” – dodaje profesor.
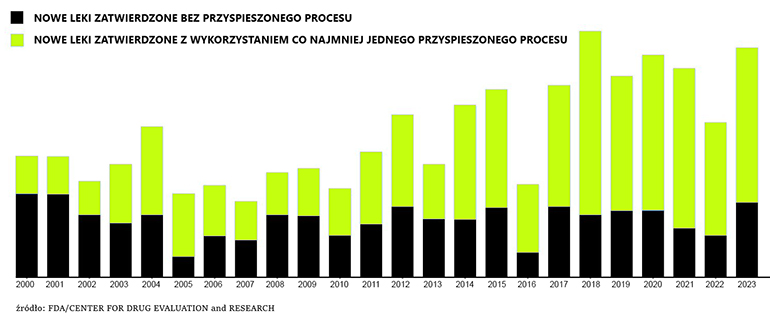
Istnieje wiele sposobów, dzięki którym firma farmaceutyczna może szybciej dostarczyć lek pacjentom. Istnieje ścieżka priorytetowego przeglądu danych, przyspieszonej akceptacji, czy też skrócenia procesu ze względu na fakt, że dana terapia stanowi przełom w medycynie lub jest wymagana jak najszybciej. Poza tymi trzema przykładami jest jeszcze kilka metod dodatkowego skracania wieloletniego procesu.
Sposoby te umożliwiają mniejszą liczbę badań, szybsze przeglądy dokumentacji lub, w niektórych przypadkach, większy dostęp do czołowych urzędników i specjalistów FDA.
Analiza danych Bloomberga wykazała, że większość nowych lekarstw w USA jest zatwierdzana w ramach jednej lub większej liczby przyspieszonych ścieżek. W zeszłym roku w ten sposób aż dwie trzecie wszystkich nowych leków trafiło na rynek.
Zdecydowana większość pomaga
Wymienione wyżej możliwości pomagają w dostarczeniu leków wiele lat szybciej niż w przypadku tradycyjnego zatwierdzenia. FDA argumentuje, że wysiłki te poprawiają opiekę medyczną, a jakiekolwiek zatwierdzenie jest zawsze objęte pewną dozą niepewności.
Wiele leków wprowadzonych na rynek w drodze przyspieszonego zatwierdzenia miało „znaczący wpływ na walkę z chorobami” – stwierdziła rzeczniczka FDA, Cherie Duvall-Jones.
W wielu przypadkach przyspieszony proces działa dobrze i pozwala na znacznie szybsze dostarczanie ważnych lekarstw pacjentom.
Huśtawka giełdowa
Proces przyspieszania wpływa na wartość firm. Wiedzą o tym inwestorzy. Akcje kompanii farmaceutycznej często rosną, gdy jeden z jej leków zakwalifikuje się do przyspieszonej ścieżki zatwierdzenia. Później, gdy preparat wykazuje oznaki, że nie działa, akcje zwykle spadają.
Przykładem jest lek na ALS firmy Amylyx Pharmaceuticals Inc. Firma zakończyła tylko jedno małe badanie, które według krytyków nie przyniosło wyraźnych korzyści, gdy producent ubiegał się o zatwierdzenie w 2022 r. Obiecano, że lek zostanie wycofany, jeśli badania ostatecznie potwierdzą, iż jest nieskuteczny. Akcje spółki wzrosły niemal natychmiast o ponad 50%, a Amylyx wyceniło leczenie na 158 000 dolarów rocznie po wejściu na rynek „priorytetową” ścieżką.
Prawie półtora roku po wejściu leku na rynek duże badanie potwierdziło to, co podejrzewali już sceptycy: lek Amylyx nie był lepszy od placebo. Akcje spółki spadły o ponad 80%.
Kiedyś było trudniej, ale dłużej
Dziesiątki lat temu FDA nie była zbyt elastyczna, a lekarstwa czasami nie były osiągalne przez lata, gdyż agencja żądała większej ilości danych.
„Teraz posunięto się w przeciwnym kierunku, czasami zatwierdzając rzeczy, na które nie ma dosłownie żadnych dowodów poza nadziejami producentów” – mówi Diana Zuckerman, prezes niedochodowego Narodowego Centrum Badań nad Zdrowiem.
Z kolei FDA stwierdza, że agencja zatwierdza leki tylko wtedy, gdy istnieją „istotne dowody”, że działają, a korzyści przewyższają ryzyko.
Teoretycznie programy przyspieszonego zatwierdzania są przeznaczone dla najbardziej obiecujących leków, które zaspokajają niektóre z najważniejszych potrzeb medycznych. W praktyce przemysł farmaceutyczny znalazł sposoby na rozszerzenie zastosowania tych ścieżek poza stosunkowo ograniczone sytuacje, dla których były pierwotnie przewidziane.
Dlaczego przyspieszamy proces
Może to wynikać z nacisków na FDA ze strony pacjentów i ich bliskich, którzy często łączą siły i są gotowi zaryzykować w obliczu śmiertelnej choroby. Jest to działanie zrozumiałe, niestety, gdy lek nie działa, winna okazuje się FDA za zbyt wczesne dopuszczenie specyfiku na rynek.
Dlaczego są problemy z wycofaniem
Innym problemem jest to, że czasami producenci leków sprzeciwiają się decyzji o wycofaniu leku, gdy okazuje się, że on nie działa. Spełnienie wszystkich prawnych i proceduralnych wymogów zajmuje długie lata, a w tym czasie cierpiący pacjenci myślą, że skoro lekarstwo jest na rynku, to musi być dobre.
Przykładem niech będzie Makena, lek zmniejszający ryzyko przedwczesnego porodu. Po 8 latach od zatwierdzenia okazało się, że nie działa. Kolejne 4 lata zajęło usunięcie go z rynku. Przez te 12 lat lek wygenerował producentowi zysk w wysokości ponad 1,6 miliarda dolarów.
FDA coraz bardziej zależne od producentów
Budżet tej agencji federalnej przez dziesięciolecia w większości finansowany był poprzez decyzje Kongresu i tylko w niewielkim stopniu agencja zarabiała na opłatach związanych z zatwierdzaniem leków. Jeszcze w 2010 roku był to stosunek około 3 do 1. W ostatnich latach opłaty od przemysłu farmaceutycznego zaczęły zbliżać się do funduszy rządowych.
W ubiegłym roku takie płatności stanowiły blisko połowę niemal 7 miliardów dolarów budżetu agencji, w porównaniu z około jedną czwartą w 2010 roku.
źródło: bloomberg
rj
















































